

近日,沐鸣开户胡可青年研究員及合作成員受自然界中天然光酶(DNA光裂合酶)修復受損傷DNA機製的啟發,提出光催化劑逐次累積紅光光子能量以達到高能激發態的策略,實現紅光催化裂解偶氮鍵🌎,並成功應用於乏氧細胞內的紅光生物正交偶氮前藥激活。該研究成果以“Nature-Inspired Photocatalytic Azo Bond Cleavage with Red Light”為題於2023年12月11日在線發表於《美國化學會會誌》(J. Am. Chem. Soc.)。沐鸣开户2019級直博生趙子建為論文第一作者,胡可青年研究員為論文通訊作者。
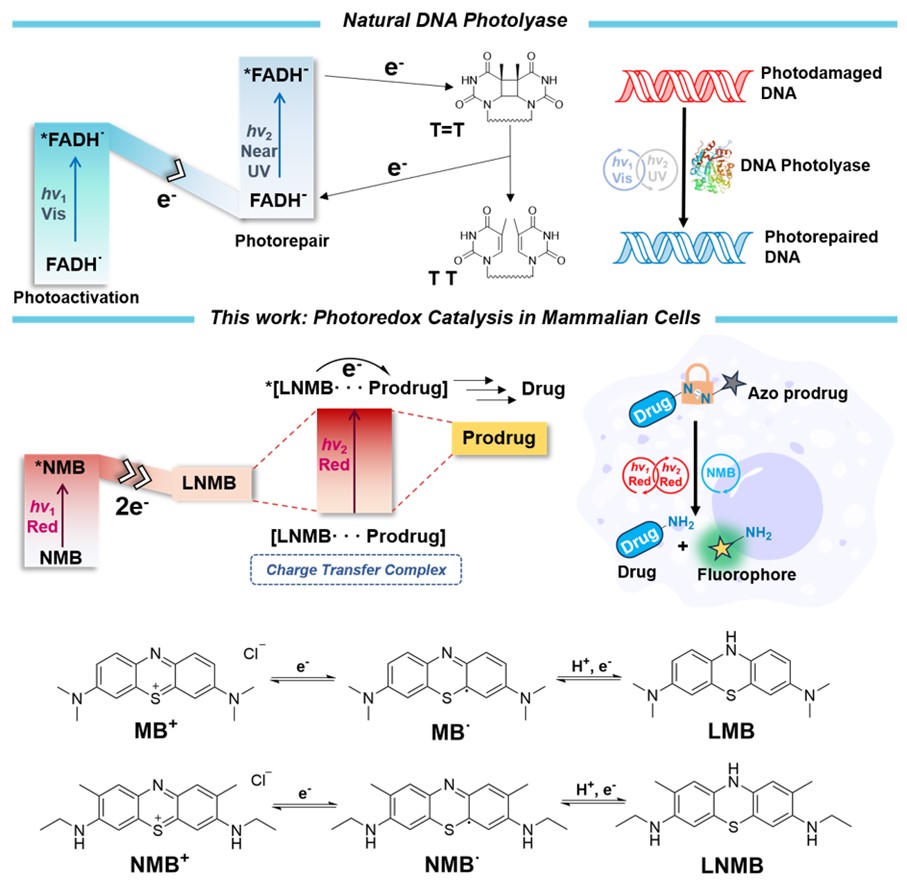
圖1. 天然光酶啟發的紅光催化偶氮鍵裂解及光催化劑結構。圖片來源💁🏿🧉:J. Am. Chem. Soc.
光催化氧化還原反應為調節細胞內多種多樣的生理過程提供了一類強有力的工具👚🧑⚕️。偶氮鍵作為一種獨特⚈、穩定的N=N雙鍵,其選擇性裂解在前藥激活、乏氧檢測及響應、適體及抗體識別以及基因調控等領域有著重要應用🌂🈹。此外,由於偶氮鍵固有的可雙側連接的特性,即可以作為識別保護基團連接兩個不同功能的分子,其在生物正交斷鍵反應中也有著巨大潛力。然而,由於偶氮鍵鍵能較大(418 kJ/mol),且完全斷裂需要4電子/質子協同🍎🏊🏽,理論上直接裂解偶氮鍵需要波長小於563nm的高能量光子👌🏽。實際上,由於偶氮化合物激發態通常具有較快的非輻射躍遷途徑,即便是在能量更高的藍光甚至紫外光激發下也很難直接打斷偶氮鍵。因此,如何在生物光學窗口(650-900 nm)內利用穿透深度高👄、光損傷小的低能量長波長光子對細胞內穩定的偶氮鍵進行選擇性裂解仍是一項巨大的挑戰。
針對上述挑戰,該團隊受自然界中天然光酶(DNA光裂合酶)修復受損傷DNA機製的啟發,即FADH通過吸收並累積多個光子能量打斷穩定的C-C鍵的光催化方式🦯,利用常見的有機紅光光敏劑亞甲基藍(MB)或其衍生分子新亞甲基藍(NMB)作為光催化劑,實現了溶液相及乏氧細胞環境下的紅光激發光催化偶氮鍵裂解及前藥激活,圖1🟪👩🏿✈️。研究人員發現紅光催化劑MB或NMB具有和天然光酶催化單元類似的氧化還原結構。並且NMB在被第一個紅光光子激發後被還原,再經歧化反應可形成一個閉殼層兩電子還原態(LNMB)🐉,LNMB可進一步與偶氮底物形成一個具有紅光吸收的電荷轉移復合物,在655nm紅光激發下🦹🏻,以NADH作為電子給體,NMB對三種FDA批準市售的偶氮前藥以及一種偶氮前藥熒光探針(SA-Azo-C)均表現出可觀的光催化激活效率。
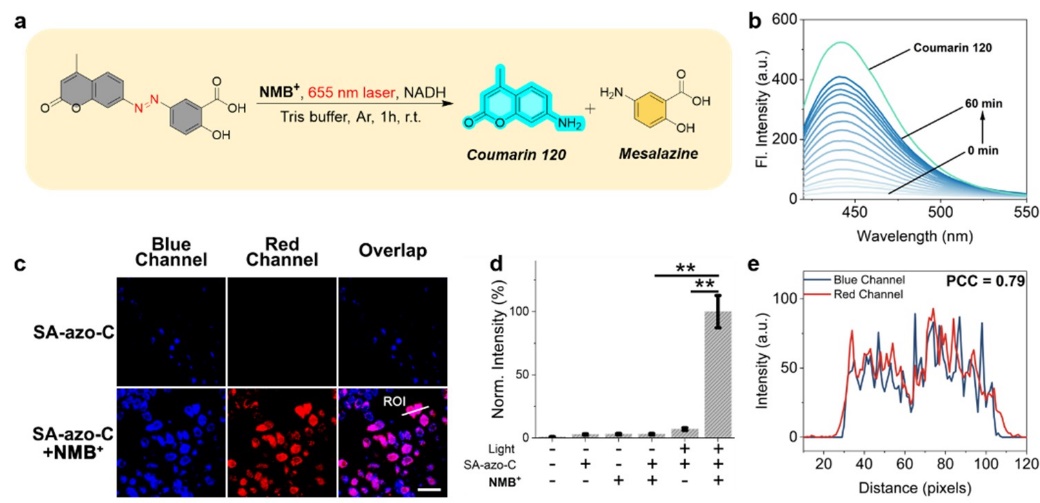
圖2. 溶液相及乏氧細胞內紅光催化偶氮前藥激活及熒光示蹤🧔♂️。圖片來源🧑🏽💼🧖♀️:J. Am. Chem. Soc.
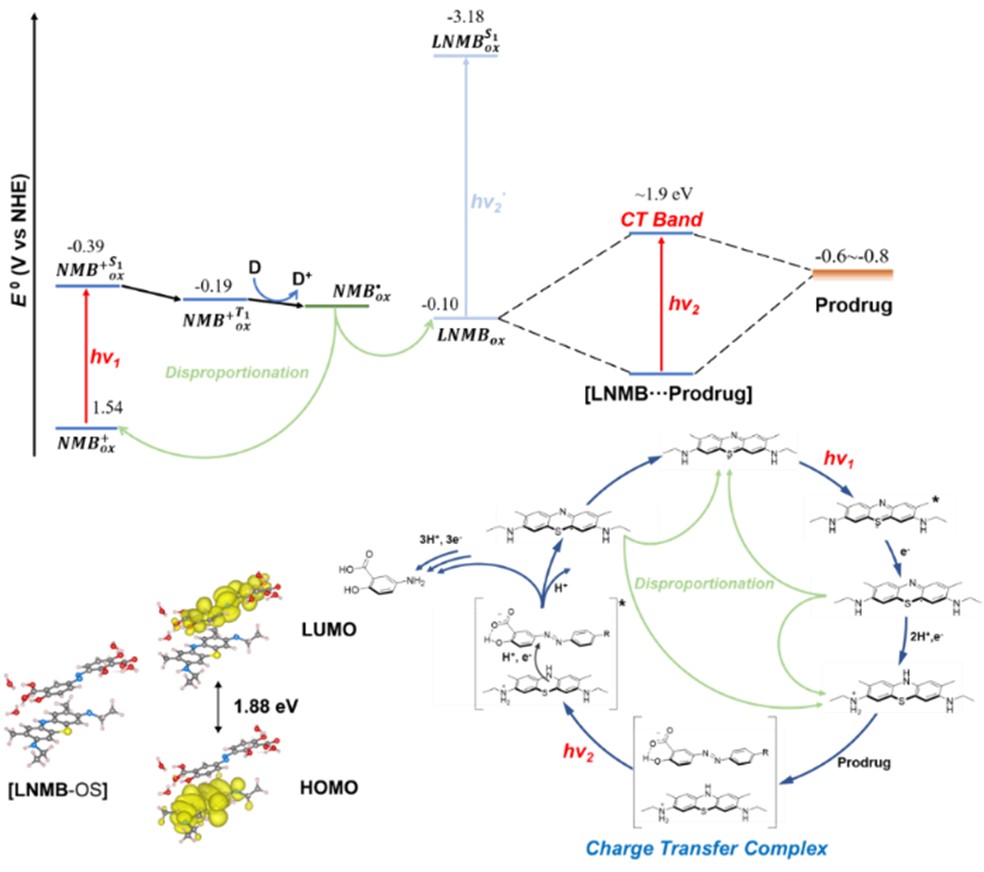
圖3. 基於電荷轉移復合物的連續紅光催化偶氮鍵裂解機理及能級圖。圖片來源:J. Am. Chem. Soc.
SA-azo-C的細胞內光催化斷鍵共聚焦熒光成像結果表明,該體系也成功應用於乏氧細胞內的紅光生物正交偶氮前藥激活,圖2。DFT結果證實LNMB可與偶氮底物形成一個電荷轉移復合物,與實驗觀測的吸收光譜結果保持一致,圖3🔆。納秒瞬態吸收光譜進一步證實該紅光吸收電荷轉移復合物的再次光激發誘導了電荷轉移復合物內的氧化還原反應,為逐次紅光光子激發誘導電子轉移引發偶氮鍵斷裂的機理提供了直接的實驗證據🟧🐸。該研究不僅在化學生物領域成功應用逐次光致電子轉移機製(Consecutive Photoinduced Electron Transfer, ConPET)實現細胞內的低能光子光催化反應,也為光催化生物正交斷鍵反應提供了一類新型的工具。
全文鏈接🧒:https://pubs.acs.org/doi/10.1021/jacs.3c09837





