

TOC🧑🏽🏭:
氨基丙二酸(Aminomalonate, Ama)是谷氨酸和天冬氨酸的同系物🏌🏼♀️,也是自然界廣泛存在的一種代謝物或結構單元。Ama被發現存在於多種天然產物,同時,也作為延伸單元參與多種非核糖體肽/聚酮天然產物的生物合成。Ama還被發現大量存在於細菌蛋白質組的堿水解液中💇🏻♂️,猜測Ama可以通過某種翻譯後修飾的方式產生,然而這樣一種核糖體途徑迄今未知。
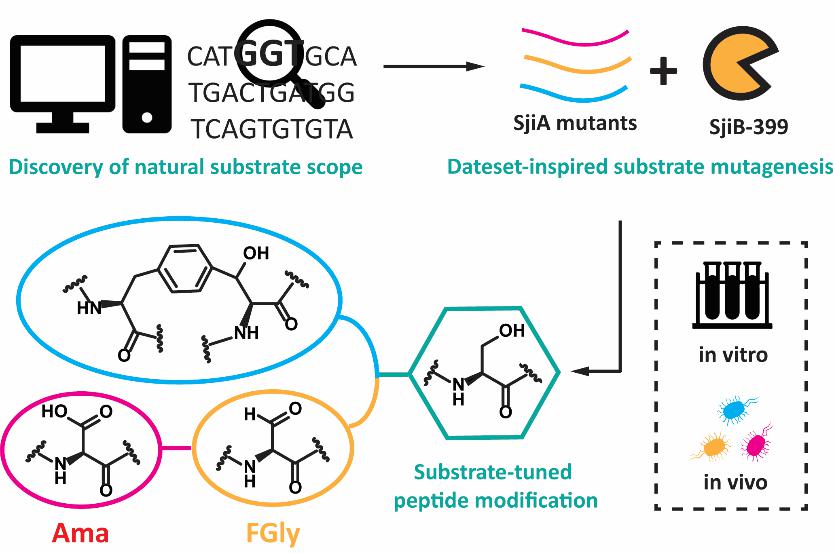
核糖體合成翻譯後修飾的多肽類天然產物(RiPPs)為發現全新的多肽生物化學提供了機會。其中S-腺苷甲硫氨酸自由基酶(rSAM)是一類存在於多種RiPPs家族的後修飾酶🧞♂️,並參與催化了諸如C-C, C-O, C-S鍵形成等多種化學上較為困難的反應🏄♂️。在這些反應中🦵,rSAM酶首先利用一個保守的[4Fe-4S]簇去還原均裂輔因子S-腺苷甲硫氨酸(SAM),產生一個高度活潑的5’-脫氧腺苷(dAdo)自由基攫取底物氫原子🖖🏼,從而引發後續的反應𓀜。近日,沐鸣平台張琪課題組對一類新發現的RiPP修飾rSAM酶,即三殘基環番成熟酶(3-CyFE),進行了詳盡的體內體外酶學實驗鑒定,報道了此類酶具有高度的催化泛雜性🤦♂️,不僅能夠催化底物FxS形成三殘基環番,也能催化Ser氧化經中間體甲醛甘氨酸(FGly)形成Ama👸🏻,闡明了Ama合成的第一種核糖體途徑。
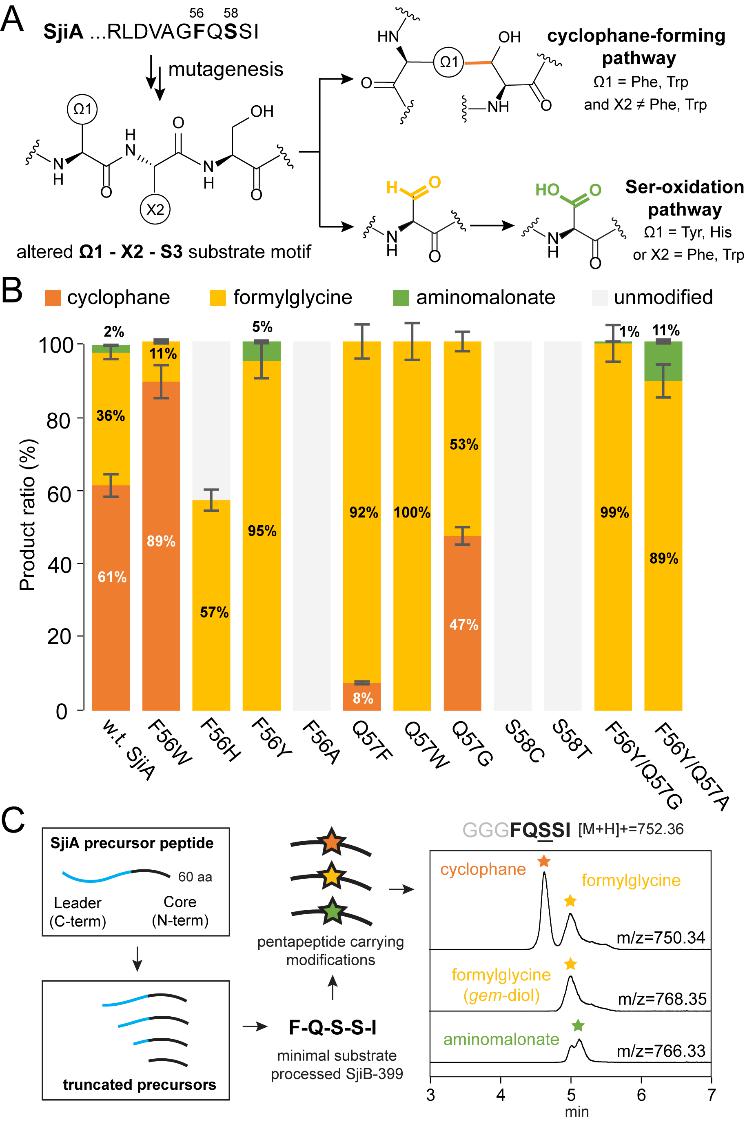
作者又通過體內共表達實驗探索了3-CyFE的底物譜,發現了此類酶的兩個特性🧚🏻♂️:1)環番形成途徑和Ser氧化途徑可以被分配給不同的底物序列😿,2)催化反應是前導肽不依賴的,這樣的兩個發現為後續多肽和蛋白的結構衍生來實現化學多樣性奠定了基礎⛈。
本研究以“Post-Translational Formation of Aminomalonate by a Promiscuous Peptide-Modifying Radical SAM Enzyme”為題在線發表於《德國應用化學》(Angew. Chem. Int. Ed.)🎊,並被評選為“hot paper”👨🦼。本文第一作者為沐鸣开户19級直博生馬溯澤和19級碩士生陳恒,通訊作者為沐鸣开户張琪教授🌾。該工作得到國家自然科學基金委項目和國家重點研發項目的支持。
全文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202107192





